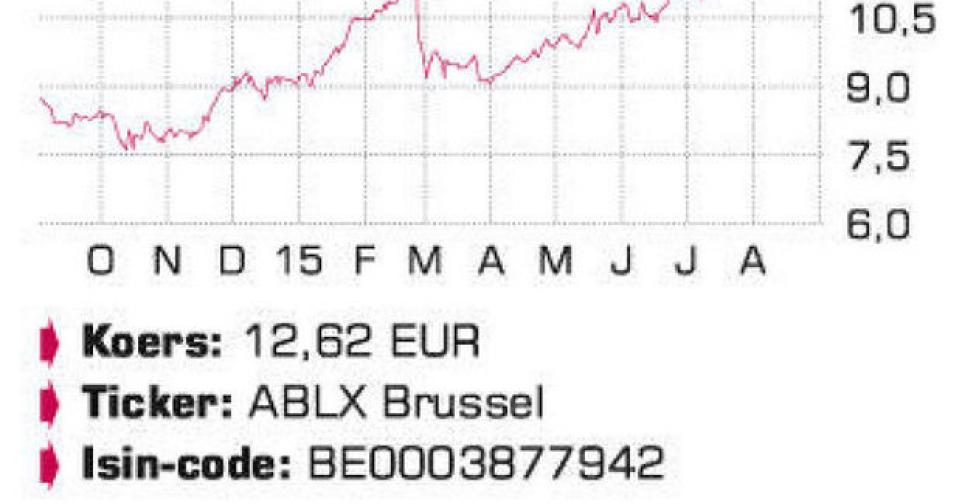
Ablynx
Met de positieve keuze voor het zelfstandig commercialiseren van caplacizumab bevestigt Ablynx de toenemende ambitie om uit te groeien tot een volwaardig commercieel biotechbedrijf.
Het belangrijkste nieuws bij de halfjaarresultaten van Ablynx was ongetwijfeld de beslissing om caplacizumab, het middel ter behandeling van de levensbedreigende bloedziekte TTP, in Europa en de Verenigde Staten zelfstandig te commercialiseren. Het biotechbedrijf toetste het afgelopen jaar alle mogelijkheden af met betrekking tot de te volgen commerciële strategie. Gezien het zeldzame karakter van de ziekte geniet caplacizumab het statuut van weesgeneesmiddel, waardoor het in Europa tien jaar marktexclusiviteit heeft. Bovendien geniet het product wegens de hoge nood sterke steun vanuit de medische wereld en is het aantal behandelende centra relatief beperkt, waardoor het uit te bouwen commerciële apparaat beheersbaar is.
Gecombineerd met de verwachte hoge prijszetting en de gefaseerde commercialisering bleek zelfstandig commercialiseren de meest waarde creërende optie. Bovendien is de kaspositie (eind juni 268,4 miljoen EUR) daarvoor voldoende gespekt, na de uitgifte in mei van een converteerbare obligatie voor 100 miljoen EUR. In de Verenigde Staten en Europa samen zijn er jaarlijks 10.000 patiënten, en het bedrijf rekent op termijn op een wereldwijde piekomzet van 300 tot 400 miljoen EUR, waarvan het gros in de Verenigde Staten en Europa.
Eerder dit jaar besliste Ablynx, na ruggenspraak met de bevoegde geneesmiddelenagentschappen in zowel Europa (EMA) als de Verenigde Staten (FDA), om in Europa op basis van de sterke fase II-resultaten een voorlopige goedkeuringsaanvraag in te dienen in de eerste jaarhelft van 2017. Binnenkort start een fase III-studie, waarvan de resultaten eind 2017 worden verwacht. Bij positieve resultaten volgen in 2018 de goedkeuringsaanvraag bij de FDA (beslissing in 2019) en de definitieve goedkeuringsaanvraag in Europa. Ablynx zit op schema om in de eerste jaarhelft van 2016 de resultaten te rapporteren van de fase IIa-studie met ALX-0171, de eerste geïnhaleerde nanobody voor het bestrijden van longinfecties veroorzaakt door RSV bij jonge kinderen.
Bij positieve resultaten start in het najaar van 2016 al een fase IIb-studie. Rond diezelfde tijd zullen de resultaten van de twee lopende fase IIb-studies met ALX-0061 tegen reuma worden gerapporteerd, waarop partner AbbVie een beslissing zal nemen over het inlicentiëren van ALX-0061. Op de resultaten van de fase II-studie tegen lupus, met bijbehorende inlicentiëringsbeslissing, is het nog wachten tot de tweede jaarhelft van 2018.
Bij de partners is het dit jaar nog uitkijken bij Merck Serono naar resultaten van de fase Ib-studie met ALX-0761 tegen psorias, en bij Boehringer Ingelheim naar de opstart van een eerste fase I-studie. Ten slotte worden dit jaar nog, vroeger dan verwacht, de eerste resultaten verwacht binnen de onlangs fors uitgebreide samenwerking met Merck & Co in het domein van kankerimmunotherapieën. De verwachte cashburn voor 2015 van 70 tot 80 miljoen EUR werd bevestigd.
Conclusie
Met de positieve keuze voor het zelfstandig commercialiseren van caplacizumab bevestigt Ablynx de toenemende ambitie om uit te groeien tot een volwaardig commercieel biotechbedrijf. Geruggesteund door een steeds matuurdere pijplijn, de te verwachten nieuwsstroom en de stevige kaspositie zien we de komende 12 tot 24 maanden heel wat opwaarts koerspotentieel. Wel bovengemiddelde risico!
Advies: koopwaardig
Risico: hoog
Rating: 1C
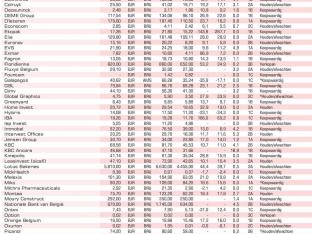
Aandelen België
Fout opgemerkt of meer nieuws? Meld het hier